
电话:029-87679000(总机)
地址:陕西省西安市西五路157号
邮编:710114
网址:www.2yuan.xjtu.edu.cn

电话:029-87679000(总机)
地址:陕西省西安市西五路157号
邮编:710114
网址:www.2yuan.xjtu.edu.cn

新年伊始,我院郭卉教授研究团队在 Cell Reports上发表了题为 “p57 increases immunotherapy efficacy by promoting cGAS-STING-mediated innate sensing in hepatocellular carcinoma” 的重磅研究。该研究系统揭示了细胞周期抑制蛋白p57在肝癌(HCC)免疫微环境重塑及免疫检查点抑制剂疗效调控中的关键作用,为HCC的免疫联合治疗提供了新的分子靶点与理论依据。通讯作者为郭卉教授,侯玉柱教授。
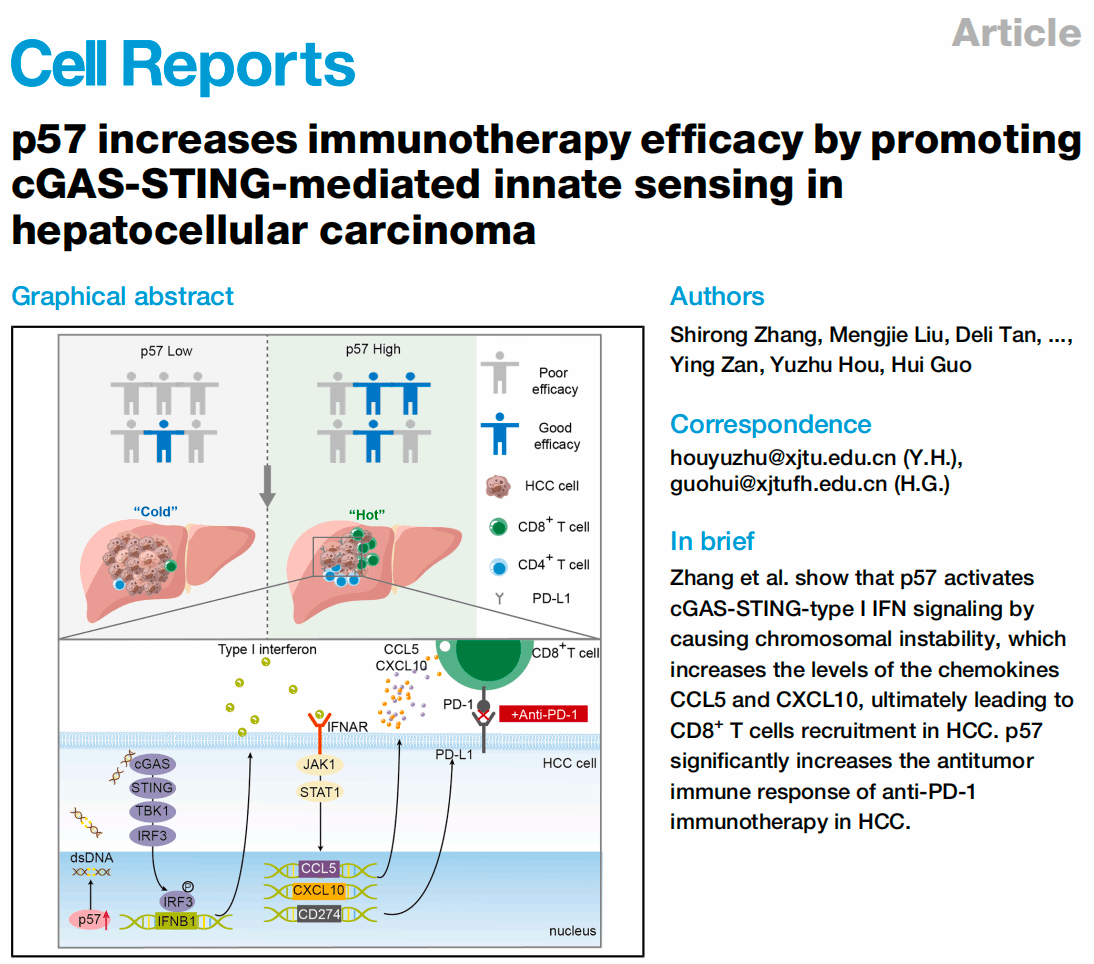
肝癌是全球高发且预后不良的恶性肿瘤之一。尽管免疫检查点抑制剂等免疫治疗手段已应用于晚期HCC,但总体应答率仍不理想。研究表明,肿瘤细胞周期异常活化与免疫逃逸密切相关。团队既往专注于肝癌细胞周期的研究,发现细胞周期蛋白依赖性激酶抑制剂p57(Cyclin dependent kinase inhibitor p57,以下简称p57)可以防止细胞周期过度活化,是明确的抑癌分子,可以作为肝癌治疗的潜在靶点,但该内源性细胞周期调控分子在抗肿瘤免疫中的作用尚目前不明确。
本研究团队首次揭示,p57表达水平与免疫治疗应答呈正相关。在针对接受PD-1单抗治疗的肝细胞癌(HCC)患者的组织样本分析中,p57阳性患者的疾病控制率显著高于p57阴性患者。考虑到CD8+T细胞在抗肿瘤免疫中的核心效应作用,其浸润水平直接影响免疫治疗效果,本研究以CD8+T细胞为主要研究对象。通过对独立队列及TCGA-LIHC数据的分析,进一步发现p57高表达与肿瘤微环境中CD8+T细胞浸润程度呈显著正相关。在多种小鼠模型中进行的验证实验表明,p57能够显著促进CD8+T细胞的肿瘤浸润,从而有效抑制肿瘤生长。
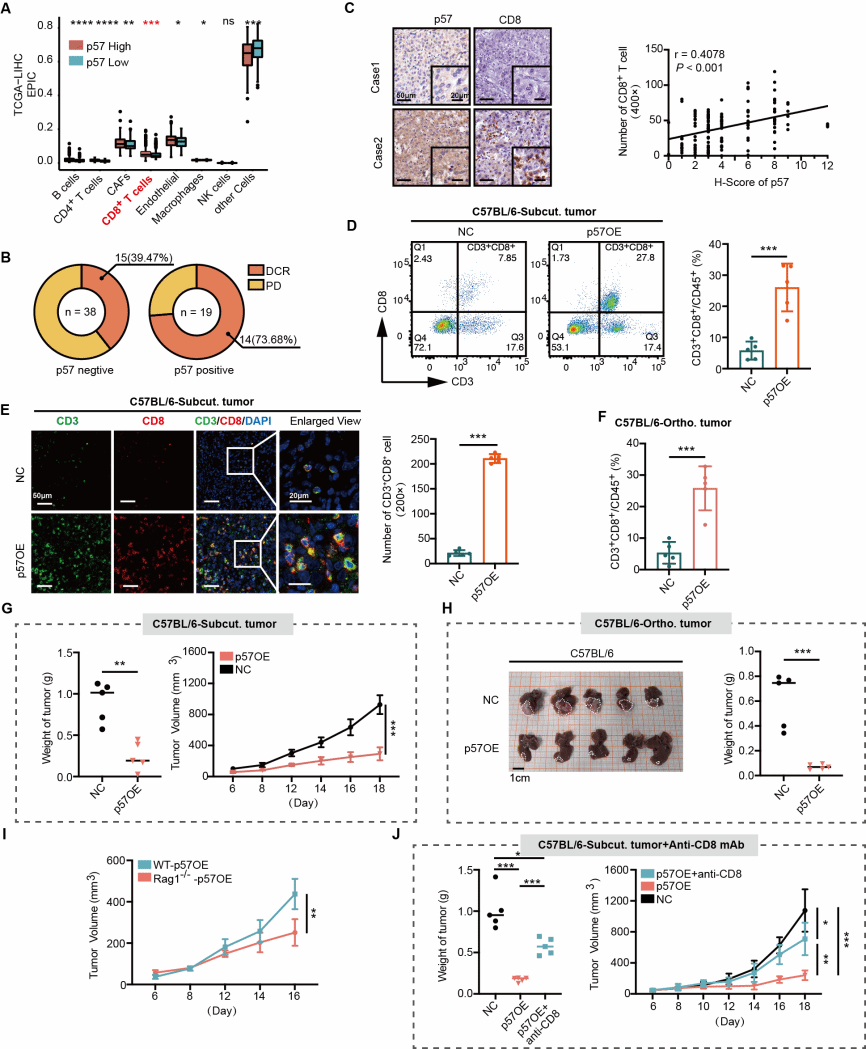
本研究还进行了机制探索:p57激活天然免疫通路,重塑肿瘤免疫微环境。1.p57通过上调趋化因子表达介导CD8+T细胞招募。研究发现,p57能够显著提高趋化因子CCL5和CXCL10的表达水平。Transwell实验证实,过表达p57的细胞培养基可明显促进CD8+T细胞迁移,而使用CCL5和/或CXCL10的中和抗体则可阻断这一迁移效应,表明p57通过CCL5/CXCL10依赖的方式招募CD8+T细胞向肿瘤浸润。2.I型干扰素通路是p57促进CD8+T细胞浸润的关键机制。p57能够显著增强肝癌细胞中IFN-β的分泌,并激活下游JAK1-STAT信号通路。RT-qPCR分析显示,p57过表达可诱导I型干扰素通路相关基因上调,包括核心病毒防御基因亚群以及主要组织相容性复合体I类(MHC-I)基因,说明p57能够有效激活I型干扰素通路。进一步实验表明,通过小干扰RNA干扰或使用I型干扰素受体抗体(Anti-IFNAR1)处理,可显著抑制趋化因子CCL5及CXCL10的表达,进而降低CD8+T细胞浸润水平,削弱p57的肿瘤抑制效果。
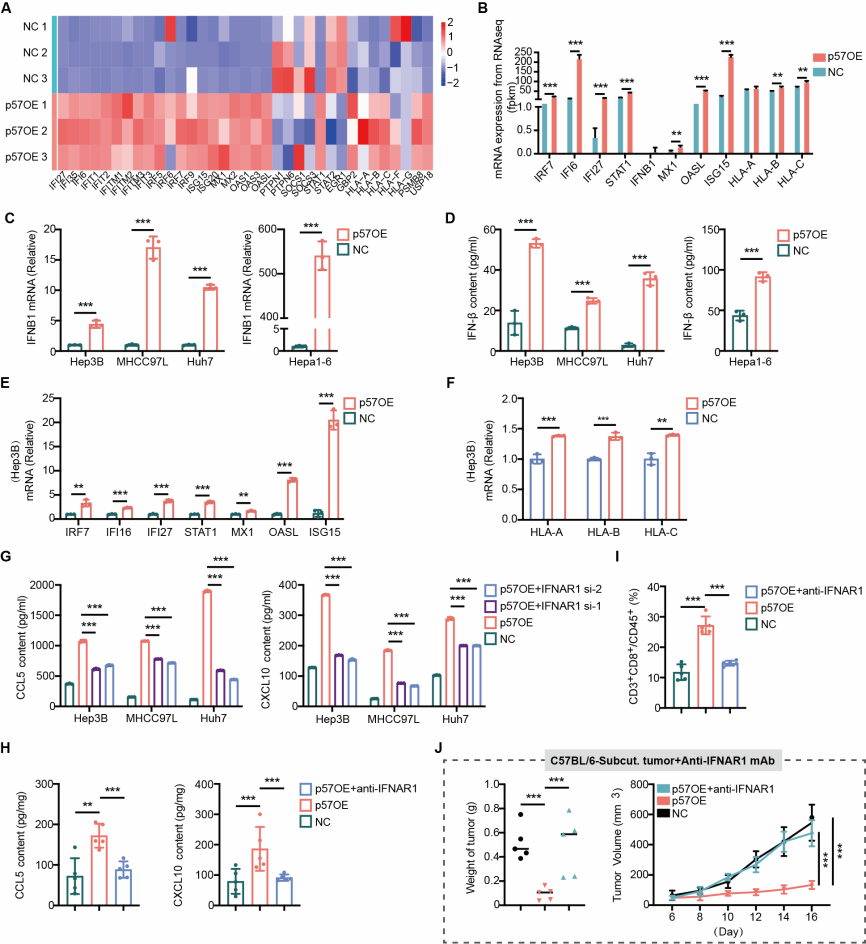
3.p57诱导染色体不稳定性,激活cGAS-STING通路:研究发现p57过表达可引发染色体不稳定性,表现为肝癌细胞中DNA双链断裂标志物γ-H2AX 表达升高和微核形成。胞质中泄漏的DNA被 cGAS 识别,激活 cGAS-STING信号轴,促进IFN-β分泌。综上,p57通过诱导染色体不稳定,激活cGAS-STING-IFN-I通路,从而促进趋化因子CCL5及CXCL10分泌,募集CD8+T细胞浸润至肿瘤微环境,使肝癌由“冷肿瘤”转变为“热肿瘤”。
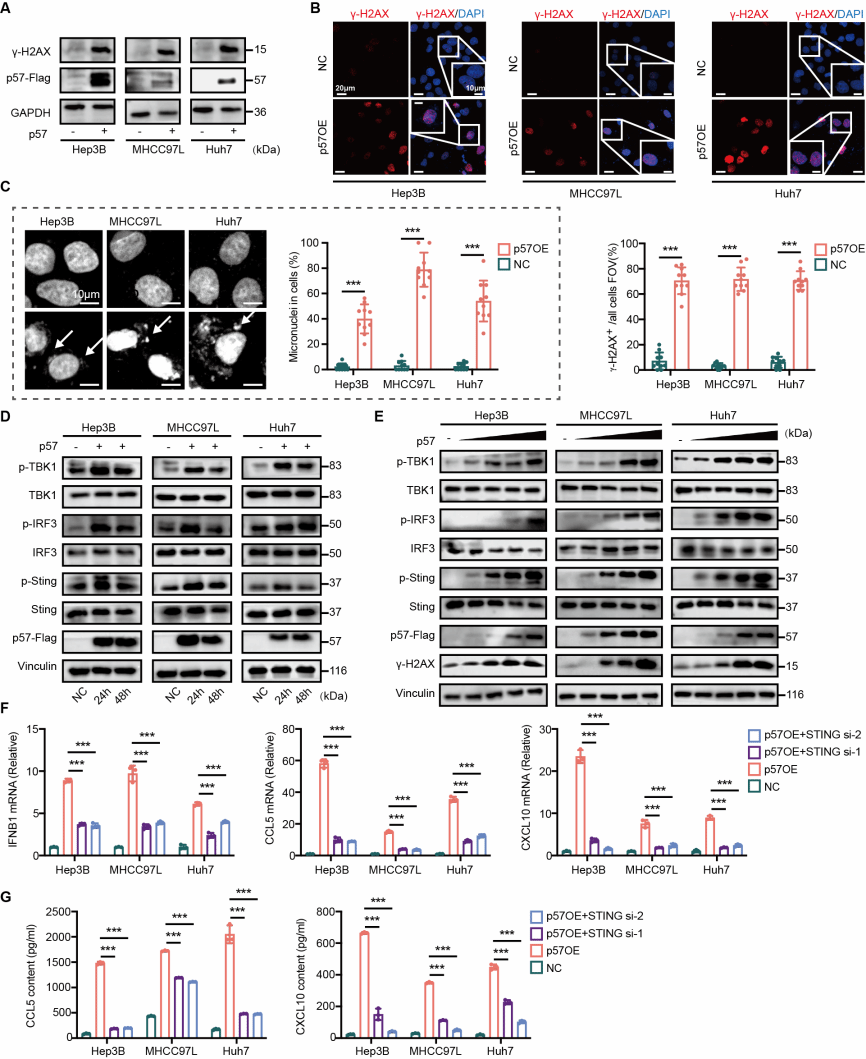
基于上述研究发现,研究团队设计了p57过表达与抗PD-1抗体联合治疗方案。在小鼠肝癌模型中,联合治疗组肿瘤体积和重量显著小于单独p57过表达组或PD-1单抗治疗组,呈现显著协同效应。
本研究阐明了升高p57通过诱发染色质不稳定→激活cGAS-STING通路→启动IFN-I信号→上调趋化因子→募集CD8+T细胞这一连贯机制,从而将“冷肿瘤”转化为“热肿瘤”,增强免疫疗效。
本研究首次阐明了内源性细胞周期抑制分子p57的免疫调节功能,揭示了细胞周期调控与天然免疫通路交叉对话在肿瘤免疫中的关键作用。为预测肝癌免疫治疗疗效提供可选的生物标志物;为免疫治疗不响应患者提供新的治疗方向。
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01541-4